近日,山东大学前沿交叉科学青岛研究院李春霞教授团队在铜-醌纳米酶激活免疫反应抑制休眠期和复发性肿瘤研究方面取得新进展,相关研究成果以“Self-destructive Copper Carriers Induce Pyroptosis And Cuproptosis for Efficient Tumor Immunotherapy Against Dormant And Recurrent Tumors”为题发表在国际知名期刊《Advanced Materials》(IF:29.4)上。硕士生乔禄颖为论文第一作者,李春霞教授、孙倩倩博士后和齐鲁医院(青岛)高海东教授为论文的共同通讯作者。
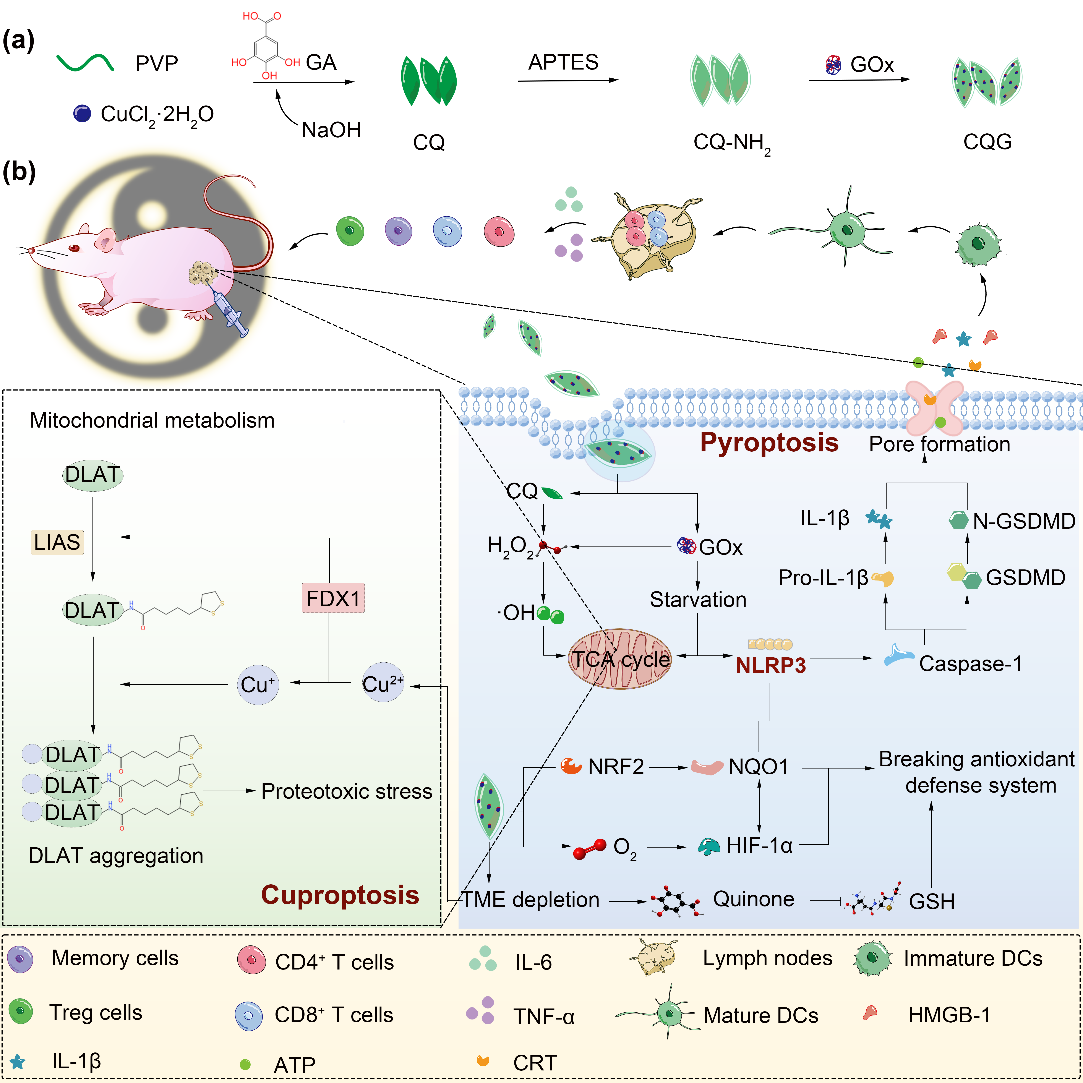
图: CQG NPs的合成路线以及诱导细胞焦亡和铜死亡协同激活免疫进而抑制休眠期和复发性肿瘤的机制。
近年来,尽管化疗、放疗和免疫疗法等癌症治疗技术不断进步,但临床上针对肿瘤复发的有效治疗策略依旧十分有限。研究发现,肿瘤复发的主要原因是残存的癌细胞进入休眠期,免疫系统难以及时识别并清除。而休眠期的癌细胞为了克服化疗、放疗等治疗对其生存所造成的负面影响最终形成了非常独特的细胞保护机制,即NRF2-NQO1通路。其中,免疫系统薄弱是休眠期肿瘤复发的主要原因,并且导致临床患者五年内存活率较低。因此,当务之急需得制定有效的策略,打破休眠期和复发性肿瘤的防御机制,同时激活强大的免疫系统,以应对肿瘤复发。
为此,该研究设计了一种自毁型铜-醌纳米酶联合葡萄糖氧化酶的纳米粒子(CQG NPs),它可以通过引发肿瘤细胞焦亡和铜死亡协同免疫治疗,同时打破独特的抗氧化防御机制,从而对抗顽固的休眠期和复发性肿瘤。这一材料的最大优点之一是CQG NPs在合成过程中通过调节碱性环境将原料没食子酸转变成了醌,醌进一步能够与铜配位,作为一种独特的铜载体。这种转化赋予了 CQG NPs 优异的四种类酶活性(类超氧化物歧化酶,类过氧化氢酶,类过氧化物酶,类谷胱甘肽过氧化物酶),并且能够消耗谷胱甘肽,产生大量氧气,导致HIF-1α 下调,进而抑制NQO1 和 NRF2 蛋白,破坏休眠期和复发性肿瘤细胞的抗氧化防御机制。
另外,自毁型CQG NPs 能在肿瘤微环境中释放的铜离子,为铜死亡的发生提供基础,同时内源性铜螯合剂谷胱甘肽含量的下降,葡萄糖的消耗以及氧气的产生将会进一步增强肿瘤细胞对铜离子的敏感性,从而增强铜死亡。此外,CQG NPs 可以通过"双管齐下 "的策略触发细胞焦亡。一方面,NQO1的下调促进了炎症小体NLRP3 的招募;另一方面CQG NPs优异的多酶活性可产生大量的活性氧,从而激活Caspase-1,切割GSDMD,造成细胞膜穿孔,同时伴随着大量炎症因子(IL-1β, IL-6等)的激活和释放,实现重塑肿瘤免疫抑制微环境,增强免疫细胞浸润,进而激活全身免疫的效果。打破休眠期和复发性肿瘤抗氧化防御机制,同时激活机体免疫可有效抑制肿瘤复发,这项工作在一系列体外实验以及体内 4T1 肿瘤小鼠模型和人源性组织异种移植(PDX)模型中得到了验证。
总而言之,本研究探索了一种基于自毁型铜-醌纳米酶放大细胞焦亡和铜死亡以实现高效的肿瘤免疫疗法的创新方法,这在对抗肿瘤休眠以防止复发的领域是前所未有的新突破,可为高效抗肿瘤治疗提供一种独特的选择和视角。
该工作得到了国家自然科学基金、山东省自然科学基金等多个项目资助。
原文链接:https://doi.org/10.1002/adma.202308241



